 Los elementos, en el campo químico, son las partes que estructuran a la tabla periódica, los cuales se ubican organizadamente en períodos y grupos. Estos presentan características fisicoquímicas comunes. Las propiedades de los elementos son aquellas características que llegan a describir a los elementos, las cuales cambian de manera secuencial por períodos y grupos.
Los elementos, en el campo químico, son las partes que estructuran a la tabla periódica, los cuales se ubican organizadamente en períodos y grupos. Estos presentan características fisicoquímicas comunes. Las propiedades de los elementos son aquellas características que llegan a describir a los elementos, las cuales cambian de manera secuencial por períodos y grupos.
Estos elementos se ubican dentro de la tabla periódica según el número atómico que posean, organizándose de una forma creciente, del mismo modo se organizan tomando en consideración las propiedades que posee cada elemento. Según las características físicas y químicas de estos elementos se clasifican en metales y no metales dentro de la tabla periódica, donde los metales se encuentran de lado izquierdos y los no metales de lado derecho.
Las propiedades principales de los elementos son: el carácter metálico, el potencial de ionización, el radio atómico, la electronegatividad, la afinidad electrónica, la estructura electrónica, valencia iónica, etc.
Indice
Propiedades de los elementos
Potencial de ionización
 Se trata de la cantidad de energía que se requiere para sacar un electrón de un átomo neutro, el cual será transformado en un catión. Esta acción dependerá directamente de la energía que tiene el elemento, lo cual lo usará para atraer a sus electrones. Esta energía llega a aumentar en los periodos desde la izquierda a la derecha, mientras que en los grupos disminuye el valor de arriba hacia abajo.
Se trata de la cantidad de energía que se requiere para sacar un electrón de un átomo neutro, el cual será transformado en un catión. Esta acción dependerá directamente de la energía que tiene el elemento, lo cual lo usará para atraer a sus electrones. Esta energía llega a aumentar en los periodos desde la izquierda a la derecha, mientras que en los grupos disminuye el valor de arriba hacia abajo.
Estructura electrónica
Refiere a la forma en que los electrones se distribuyen en el átomo, en donde se ubican en diversos niveles y subniveles de energía. En general los elementos de un período llegan a presentar un electrón externo adicional en el mismo nivel de energía.
Radio atómico
Es alrededor de este y de los niveles del núcleo que se llegan a organizar los electrones, los cuales se disponen entre la última capa y el núcleo. Estos en grupos aumentan de arriba hacia abajo, pero a lo largo del periodo llegan a disminuir.
Radio iónico
 Corresponde al radio que presenta un ión dentro de un cristal iónico, aquí los iones se comienzan a empaquetar hasta que sus orbitales externos entran en contracto entre sí. Un orbital en este caso corresponde al área en torno al átomo, donde resulta máxima las posibilidades de hallar a un electrón.
Corresponde al radio que presenta un ión dentro de un cristal iónico, aquí los iones se comienzan a empaquetar hasta que sus orbitales externos entran en contracto entre sí. Un orbital en este caso corresponde al área en torno al átomo, donde resulta máxima las posibilidades de hallar a un electrón.
Electronegatividad
Se refiere a la capacidad que muestra un determinado elemento para atraer los electrones de enlace que posee otros elementos. Esta suele aumentar en los periodos desde izquierda a derecha, y en los grupos aumenta en dirección ascendente, o sea, desde abajo hacia arriba.
Afinidad electrónica
Se trata de la energía que libera un átomo cuando capta un electrón mientras se encuentra en estado gaseoso, punto que hace crear un ión gaseosos negativo. Aquí el átomo pasará a ser un anión.
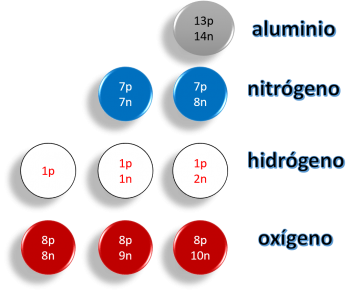
Número atómico
Este es el número que representa la cantidad total de protones y electrones que posee el átomo en su corteza. Este llega a indicar el lugar que ocupa el elemento dentro de la tabla periódica.
Punto de ebullición
 Indica la temperatura en donde un compuesto o la forma líquida del elemento se halla en equilibrio con la forma gaseosa.
Indica la temperatura en donde un compuesto o la forma líquida del elemento se halla en equilibrio con la forma gaseosa.
Punto de fusión
Indica la temperatura en donde el compuesto o la forma sólida del elemento se halla en equilibrio con una forma líquida.
Masa atómica
La masa atómica llega a representar la cantidad de partículas que posee la corteza. Esta indica una medida ponderada de las unidades de masa que posee los isótopos del elemento.
Densidad
Esta propiedad llega a indicar la cantidad de masa por unidad que contiene el volumen de un medio. Esta se expresa según el sistema internacional de unidades en kilogramos por metro cúbico.

