 Los no metales son elementos químicos que no tienen capacidad para conducir calor ni electricidad. Estos son muy débiles, por tanto no pueden convertirse en láminas ni estirarse.
Los no metales son elementos químicos que no tienen capacidad para conducir calor ni electricidad. Estos son muy débiles, por tanto no pueden convertirse en láminas ni estirarse.
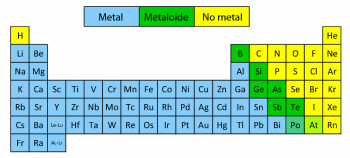
En la tabla periódica hay un total de 25 no metales los cuales tienen distintas características químicas, y la gran mayoría de estos son muy empleados en sistema biológicos. Dentro de este grupo se encuentran los halógenos como son el yodo, el bromo, cromo, el flúor, téneso, etc. Estos no metales poseen en su última capa de valencia 7 electrones.
Se encuentra localizado a la derecha de la Tabla Periódica, específicamente encima de la línea quebrada de los grupos 14 al 17. Cada elemento no metálico es colocado en orden acorde a su número atómico, estos se van agrupando según su relación en cuanto a sus propiedades, siendo ordenados en 18 grupos o familias.
Un ejemplo claro de elementos no metálicos son el Helio, el Flúor, el Cloro, el Xenón, el Oxígeno, el Carbono, el Bromo, el Astato, el Argón, el Radón, el Nitrógeno, etc.
¿Cuales son la propiedades físicas de los no metales?
 Se presentan en los tres estados físicos de agregación.
Se presentan en los tres estados físicos de agregación.- Puede ser en temperatura ambiente: Gaseosos, como el hidrógeno y el oxígeno; sólidos: como el carbono y el azufre; y líquidos: como el bromo.
- No tienen capacidad de estirarse o doblarse.
- No son maleables ni dúctiles.
- En su mayoría llegan a ser gases.
- Tienden a cambiar mucho en función de su apariencia.
- No son tenaces, dúctiles ni maleables.
- No reflejan la luz.
- Son frágiles y no se pueden convertir en láminas ni en hilos.
- Todas sus moléculas están conformadas por dos o más átomos.
- Tienen un bajo peso específico y un alto potencial de ionización.
- Presentan variados colores.
- No tienen brillo metálico: únicamente el yodo posee esta características.
- Su punto de fusión es bajo, a excepción del diamante, el cual es una forma de carbono que se llega a fundir a una temperatura de 3570 grados C.
- No conducen la electricidad ni el calor.
Propiedades químicas de los no metales
- Suelen adquirir carga negativa cuando se ionizan.
- Los átomos que le componen suelen tener de 5 a 7 electrones en su última capa de valencia.
- Al combinarse con metales crean compuestos iónicos, mientras que al hacerlo con no metales da a lugar compuestos covalentes. Independientemente de con quien se forme siempre se llega a cumplir la regla del octeto.
- Tiene una electronegatividad de mediana a alta.
- Son empleados como aislantes por su nula o reducida conducción de calor y electricidad. También pueden ser usados como semiconductores dentro de dispositivo y aparatos.
- Muchos de los no metales llegan a tener alotropía.
- Llegan a formar compuestos iónicos con los metales.
 Llegan a ganar electrones para completar su última capa de valencia con 8 electrones.
Llegan a ganar electrones para completar su última capa de valencia con 8 electrones.- Se llegan a reducir por ganancia de electrones.
- Suelen formar anhídridos cuando se unen con el oxígeno, y a la vez crean oxoácidos cuando luego se combinan con el agua.
- Forman parte del bloque p de la tabla periódica.
- Suelen ganar electrones, los cuales son transformados en aniones o iones negativos.
- Presenta una electronegatividad que va de mediana a alta.
- Presenta moléculas que son por lo general covalentes y biatómicas.
- El oxígeno y los halógenos llegan a ser los más activos.
- Tienen moléculas conformadas por dos o por un conjunto de átomos.
- Llegan a formar parte de ciertas biomoléculas orgánicas como es el caso de las proteínas, de los glúcidos y de los lípidos.
- Suelen formar óxidos anhídridos o no metálicos cuando se mezclan con el oxígeno.
- Llegan a formar parte de los bioelementos primarios como es el caso del azufre, el hidrógeno, del carbono y del nitrógeno.

