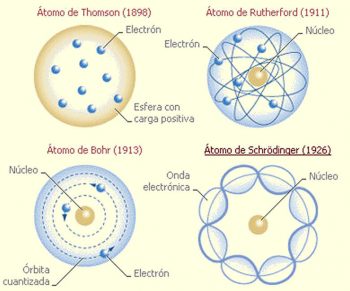
 El modelo atómico de Schrödinger es conocido como el modelo mecánico cuántico del átomo. Esta propuesta no relativista está basada en la ecuación que el físico austríaco Erwin Schrödinger desarrolló en el año 1925, mediante la cual definía al principio los electrones como ondas de materia, describiendo de este modo la ecuación ondulatoria que explicaba el desarrollo en el tiempo y el espacio de la onda material en cuestión.
El modelo atómico de Schrödinger es conocido como el modelo mecánico cuántico del átomo. Esta propuesta no relativista está basada en la ecuación que el físico austríaco Erwin Schrödinger desarrolló en el año 1925, mediante la cual definía al principio los electrones como ondas de materia, describiendo de este modo la ecuación ondulatoria que explicaba el desarrollo en el tiempo y el espacio de la onda material en cuestión.
El electrón venía definido con su carácter ondulatorio por una función de ondas (Ψ), usando una ecuación de ondas sencilla que era diferencial de segundo grado, donde aparecían derivadas segundas de Ψ.
Al resolverse esta ecuación, la función depende de unos parámetros que son los números cuánticos, y de ese modo, el cuadrado de la función de ondas correspondía con la probabilidad de encontrar al electrón en una región concreta.
Al encontrar el electrón, esto introducía en el Principio de Heisenberg, el cual establece que no es posible estimar la posición ni la energía de un electrón. Por esta razón, en el modelo de Schrödinger aparece un concepto para definir la región del espacio en la cual cabría mayor posibilidad de hallar al electrón, la cual sería *el orbital*.
Indice
El Modelo Atómico de Schrödinger
Ecuación del Modelo Atómico de Schrödinger.
 El modelo atómico de Schrödinger postula que: los electrones son ondas de materia que se distribuyen en el espacio según la función de ondas (Ψ):
El modelo atómico de Schrödinger postula que: los electrones son ondas de materia que se distribuyen en el espacio según la función de ondas (Ψ):
(δ2Ψ/δx2) + (δ2Ψ/δy2) + (δ2Ψ/δz2) + (8π2m/h2)(E-V)Ψ = 0.
Los electrones se distribuyen en orbitales que son regiones del espacio con una alta probabilidad de encontrar un electrón. La misma está determinada por el cuadrado de la función de ondas (Ψ2).
Dado esto, se tienen en cuenta los siguientes números cuánticos:
- Número cuántico principal (n = 1, 2, 3…): indica el nivel de energía del electrón y su distancia al núcleo.
- Número cuántico secundario o Azimutal (l = 0, 1, 2,…, n-1): subniveles energéticos para cada n.
- Número cuántico magnético (m): orientación del orbital ante campos magnéticos externos. Valores entre -l y + l.
- Número de espín (s): sentido del giro del electrón. Valores 1/2 y – 1/2.
En un átomo no puede haber electrones con los cuatro números cuánticos iguales. La configuración electrónica del modelo atómico de Schrödinguer explica las propiedades periódicas de los átomos y los enlaces que forman.
Postulados del Modelo Atómico de Schrödinger.
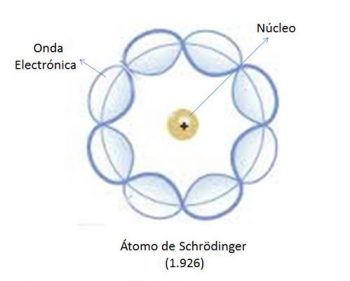 La configuración electrónica del modelo atómico de Schrödinguer explica las propiedades periódicas de los átomos y los enlaces que forman.
La configuración electrónica del modelo atómico de Schrödinguer explica las propiedades periódicas de los átomos y los enlaces que forman.
Sin embargo, el modelo atómico de Schrödinger no contempla el spin de los electrones, y tampoco considera las variaciones del comportamiento de electrones rápidos debido a efectos relativistas.
Sus postulados son:
- Los electrones se comportan como ondas estacionarias que se distribuyen en el espacio según la función de onda Ψ.
- Los electrones se desplazan dentro del átomo describiendo orbitales. Estos son zonas en donde la probabilidad de encontrar un electrón es considerablemente más alta y proporcional al cuadrado de la función de onda Ψ2.
Logros del Modelo Atómico de Schrödinger.
Este modelo atómico predice adecuadamente las líneas de emisión espectrales, tanto de átomos neutros como de átomos ionizados. También la modificación de los niveles energéticos cuando existe un campo magnético o eléctrico.
Fallas del Modelo Atómico.
El modelo de Schrödinger en su formulación original no tiene en cuenta el espín de los electrones, esta deficiencia es corregida por el modelo de Schrödinger-Pauli. El modelo ignora los efectos relativistas de los electrones rápidos, esta deficiencia es corregida por la ecuación de Dirac que además incorpora la descripción del espín electrónico.
Este aunque predice razonablemente bien los niveles energéticos, por sí mismo no explica por qué un electrón en un estado cuántico excitado decae hacia un nivel inferior si existe alguno libre. Esto fue explicado por primera vez por la electrodinámica cuántica y es un efecto de la energía del punto cero del vacío cuántico.


