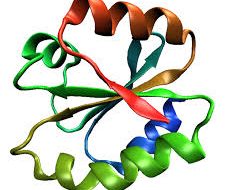
 La actividad biológica de una proteína depende en gran parte de la disposición espacial de su cadena polipéptica. Esta cadena es aquella constituida por una serie de plegamientos que son los que le proporcionan complejidad a la proteína y por ello se definen 4 niveles distintos:
La actividad biológica de una proteína depende en gran parte de la disposición espacial de su cadena polipéptica. Esta cadena es aquella constituida por una serie de plegamientos que son los que le proporcionan complejidad a la proteína y por ello se definen 4 niveles distintos:
- Estructura primaria.
- Estructura secundaria.
- Estructura terciaria.
- Estructura cuaternaria.
La estructura secundaria de las proteínas es aquella que se adopta gracias a una formación de enlaces de hidrógeno, conocidos como puentes entre los átomos que forman el enlace peptídico.
Indice
Postulados de Pauling y Corey
Pauling y Corey descubrieron las principales características que forman parte del nivel de organización de una proteína al hacer estudios sobre la estructura secundaria de las proteínas. Las principales características que deben tener estas según su nivel de organización son:
- Los átomos de enlace peptídico y la configuración del enlace trans deben estar en un mismo plano.
- Alrededor del carbono alfa se da la rotación (solo es posible atreves de este).
- La cadena lateral R de los aminoácidos no está involucrada en esta estructura.
- De la serie L (los aminoácidos).
- Son cercanos a la línea polipéptica los hidrógenos que forman puentes de hidrógeno. Esta línea une los atamos de oxigeno y nitrógeno.
Estructura del nivel secundario de las proteínas.
En este nivel podemos encontrar:
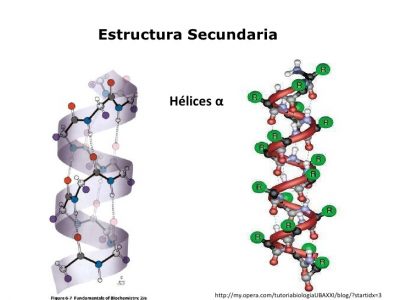
- Alfa-hélice.
- Giros beta, también conocidos como vueltas Beta o vueltas inversa.
- Beta-lamina o estructura en hoja beta plegada, que pueden ser de dos tipos paralela y antiparalela.
Tipos de estructura secundaria
Son conocidos solo tres tipos de estructura secundaria en las proteínas que son la:
- La a- hélice.
- La lamina B o lamina plegada.
- La hélice de colágeno.
La a-hélice
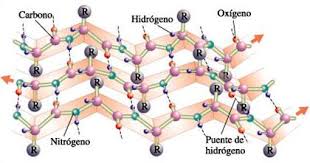 Esta estructura es formada al enrollarse la cadena peptídica sobre sí misma en el sentido de las agujas del reloj, a lo que los intelectuales llamarían de forma dextrógira.
Esta estructura es formada al enrollarse la cadena peptídica sobre sí misma en el sentido de las agujas del reloj, a lo que los intelectuales llamarían de forma dextrógira.
Esa estructura es común en proteínas que poseen un elevado número de aminoácidos con radicales hidrófilos o grandes, ya que las cargas de estas hacen interacción con las moléculas de agua a su alrededor (que la rodean). La estructura es estabilizada gracias a la gran cantidad de enlaces realizados por los puentes de hidrógeno que se establecen entre el –NH de un aminoácido y el –c=0 del cuarto aminoácido.
La a-hélice pude presentar 3,6 aminoácidos por vuelta. Por esta razón, en la a-hélice los oxígenos de todos los grupo –C=0 van orientados hacia el mismo sentido mientras que los hidrógenos presentes en los demás grupos van orientados al sentido contrario y los radicales de los aminoácidos dirigidos hacia el exterior de la hélice.
Lamina plegada o lamina B
La conformación de esta es volver a la estructura primaria de las proteínas, ya que en esta se da lo que conocemos como B-queratina que se halla presente en el pelo y las uñas.
 Esta estructura tiene una forma de Zig-Zag y varias son las cadenas que se disponen en paralelo para la formación de esta lámina.
Esta estructura tiene una forma de Zig-Zag y varias son las cadenas que se disponen en paralelo para la formación de esta lámina.
En esta, no existen enlaces de hidrógeno entre los aminoácidos cercanos a la cadena polipéptida, esta se estabiliza mediante la creación de puentes de hidrógeno entre los grupos –C=0 Y –NH de las cadenas paralelas.
Hay dos clases de esta:
La antiparalela: Formadas al existir dos cadenas polipéptidas corriendo en direcciones opuestas.
Las paralelas: dada cuando las cadenas paralelas adyacentes corren hacia la misma dirección.
Hélice de colágeno
Además de las estructuras mencionadas anteriormente, como es el caso de la a-hélice y la lamina plegada, también hay otro tipo de estructura secundaria de las proteínas como es el caso de la triple hélice de colágeno.
Esta es una estructura particularmente rígida en la que se presenta el colágeno, que forma parte de los tejidos conectivos y los tendones.
Cuándo hay una asociación de tres hélices que se enrollan entre ellas (llamadas levógiras) en el sentido de las manecillas del reloj y estas se unen mediante enlaces de tipo puente de hidrógeno, entonces nos estamos refiriendo al colágeno.
El hecho de que una proteína llegue a adquirir una u otra estructura secundaria depende de su secuencia de aminoácidos o su estructura primaria. Lo que quiere decir que una cadena polipeptídica puede llegar a adquirir deferentes estructuras secundarias y en diferentes partes o segmentos de la misma.

