 El potasio se define como un elemento químico, su número atómico es 19, forma parte de la tabla periódica de los elementos y su símbolo químico se representa con la letra K.
El potasio se define como un elemento químico, su número atómico es 19, forma parte de la tabla periódica de los elementos y su símbolo químico se representa con la letra K.
Este metal se caracteriza por ser alcalino, su tonalidad es plateada y blanca. Es abundante en la naturaleza en los elementos que se relacionan con el agua salada y demás minerales.
Tiene una rápida oxidación con el aire, es bastante reactivo, mayormente en agua. Guarda similitudes químicas con el sodio. Este es el quinto metal más liviano y ligero, es un sólido de carácter blando, puede cortarse fácilmente con un cuchillo. Su punto de fusión es bastante bajo, su llama es de color violeta.
Tiene una tonalidad plateada en las superficies que se exponen al aire, estas se oxidan rápidamente cuando entran en contacto con el mismo, por lo tanto el potasio debe ser guardado con un recubrimiento de aceite.
Similar a otros metales alcalinos, tiene una violenta reacción con el agua y desprende hidrógeno. De hecho, puede inflamarse de forma espontánea cuando está en contacto con el agua.
Configuración Electrónica del Potasio
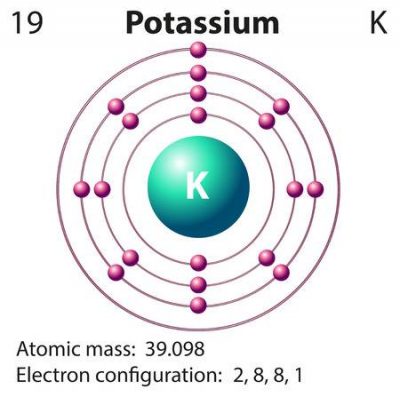 La configuración electrónica completa de este elemento es 1s2 2s2 2p6 3s2 3p6 4s1 y la configuración electrónica abreviada es [Ar] 4s¹.
La configuración electrónica completa de este elemento es 1s2 2s2 2p6 3s2 3p6 4s1 y la configuración electrónica abreviada es [Ar] 4s¹.
Gracias a la configuración electrónica de los elementos es posible determinar la estructura de los electrones que tienen los átomos de este. El potasio integra el período 4 de la tabla periódica, por lo tanto, posee cuatro niveles electrónicos. Cada uno de estos tiene distintos tipos de subniveles.
El potasio se presenta como un elemento químico cuyos colores son plateado y blanco. Se distingue gracias al número atómico 19 el cual se presenta en la posición 19 de la tabla periódica. Esto significa que en total el potasio tiene 19 electrones distribuidos de la siguiente forma:
En la primera capa hay 2 electrones, en la segunda capa existen 8, en la tercera capa se encuentran 8 electrones y en la cuarta y última capa hay sólo 1 electrón. Su símbolo atómico es la letra K, forma parte de los metales alcalinos.
Solido es el estado natural en el cual el potasio es encontrado en la naturaleza. De igual forma, su estructura cristalina cúbica centrada en el cuerpo.
Usos del Potasio
- El nitrato y el cloruro se usan como fertilizantes.
- El potasio metal es empleado en células fotoeléctricas.
- El carbonato potásico se usa para crear cristales.
- El nitrato es usado para crear cromato, pólvora y dicromato en la pirotecnia.
- El cloruro de potasio se emplea para ejercer un paro cardíaco cuando se ejecutan inyecciones letales.
- Una aleación de potasio y de sodio escrita como NaK, es un material usado para transferir calor.
- Un mecanismo como la bomba de sodio sirve para obtener concentraciones requeridas de iones en el interior y en el exterior de la célula con las cuales se realiza la transmisión del impulso nervioso.
- Existen sales de potasio de gran importancia como cianuro, bromuro, yoduro, sulfato e hidróxido.
- La disminución del nivel de potasio en la sangre produce hipopotasemia.
- Las hortalizas tales como remolacha, brócoli, coliflor y berenjena junto a las judías, frutas, bananos, albaricoque, aguacate, cereza, melocotón y ciruela son alimentos cuyo nivel de potasio es alto.
- El elemento del potasio representa ser uno de los elementos de mayor importancia para que las plantas crezcan. Este es uno de los tres elementos que las plantas consumen en grandes cantidades debido a que el ion potasio, que puede encontrarse en casi todos los tipos de suelo, tiene una importante intervención en el proceso de la respiración de las plantas.

