 Los ácidos son una clase diferente de compuestos porque sus propiedades tienen soluciones acuosas. Es muy común encontrarlos en la mayoría de los alimentos que se consumen.
Los ácidos son una clase diferente de compuestos porque sus propiedades tienen soluciones acuosas. Es muy común encontrarlos en la mayoría de los alimentos que se consumen.
Las frutas cítricas como los limones y las naranjas están compuestas de ácido ascórbico y ácido cítrico al que comúnmente se le llama vitamina C.
Los electrolitos son las soluciones acuosas de los ácidos, esto quiere decir que pueden trasladar la corriente eléctrica. Algunos ácidos son electrolitos fuertes debido a que pueden ionizar en su totalidad al agua, creando una enorme cantidad de iones.
Existen otros ácidos los cuales son electrolitos débiles, aunque mayormente se encuentran en manera no ionizada cuando son disueltos en agua. El sabor de los ácidos es agrio. Los caramelos agrios, el vinagre y los limones también están compuestos de ácidos. Los ácidos pueden cambiar el color de algunas indicaciones que son ácido-base.
Indice
Características propiedades químicas de los Ácidos
 Pueden transformar la tonalidad del naranja metálico de naranja a rosa o a amarillo.
Pueden transformar la tonalidad del naranja metálico de naranja a rosa o a amarillo.- Cambian el tono del tornasol de azul a un color rojo.
- Tienen la capacidad de conducir a la electricidad.
- También pueden transformar La tonalidad rosa de la fenolftaleína en incoloro.
- Los ácidos normalmente desarrollan el gas hidrógeno e interaccionan con metales activos como Mg, Zn, entre otros.
- Existen ácidos que tienen un alto nivel de corrosividad por naturaleza, lo que quiere decir que pueden oxidar o corroer a los metales.
- Cuando los ácidos se mezclan con una base, pierden su acidez.
- Cuando se mezclan con agua, producen iones H+.
- El valor del pH que tiene el ácido es 0-6.
- Cuando cantidades iguales de base y de ácido se combinan, se desarrolla el proceso de neutralización y se forma el agua y la sal.
- Los ácidos tienen reacción con los carbonatos de hidrógeno y con los carbonatos para crear agua, gas salino y dióxido de carbono.
- El sabor de los ácidos es agrio.
- Los ácidos débiles no actúan con metales. Por ejemplo: el ácido carbónico.
- Los metales que son sumamente activos como el Calcio (C), Potasio (K) y el Sodio (Na) suelen explotar cuando tienen combinaciones con ácidos.
- Los metales que usualmente reaccionan con ácido diluido para crear hidrógeno y sales son los metales que están encima del hidrógeno ubicándose en la serie de actividad del metal.
- Los ácidos nítricos no tienen propiedades ácidas pero si propiedades oxidantes.
- Los sulfuros metálicos y los ácidos crean sulfuro de hidrógeno y sal.
- Mientras los ácidos reaccionan con los bisulfitos y los sulfitos, estos crean agua, dióxido de sal y azufre.
- Los distintos tipos de ácidos son: ácidos minerales, ácidos orgánicos, ácidos débiles, ácidos fuertes, ácidos diluidos, ácidos concentrados, ácidos monobásicos, hidróxidos, ácidos óxiduos, ácidos tribásicos y ácidos dibásicos.
- Los ácidos se clasifican de acuerdo a su función de potencia, fuentes, presencia de oxígeno, concentración y basicidad.
Fuerza de los Ácidos
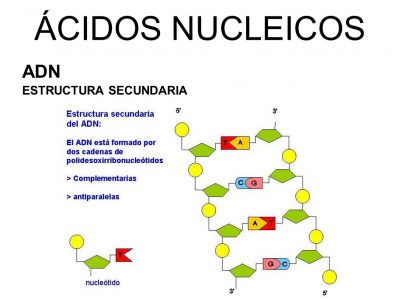 La fuerza de los ácidos es medida en una escala a la que se le llama escala de pH.
La fuerza de los ácidos es medida en una escala a la que se le llama escala de pH.
El valor que tiene el pH en una solución es la representación de la concentración de iones de hidrógeno de la misma.
Un valor de pH 7 expresa una solución neutra, mientras que un valor de pH inferior a 7 es igual a una solución ácida.
Cuanto menor sea el valor de pH, la concentración de iones de hidrógeno es mayor y el ácido es más fuerte. Los ácidos más fuertes, tales como el ácido de las bacterias, tienen valores de pH que se acercan a 0.
Detección de Ácidos
Algunos compuestos a los que se le conoce por el nombre de indicadores, cambian su tonalidad cuando los ácidos contactan con ellos. Por lo tanto, pueden usarse indicadores para detectar a los ácidos.
Un ejemplo de esto es el compuesto conocido como tornasol. Este se ubica encima de tiras de papel pequeñas que pueden ser azules o rojas. Cuando se colocan gotas de ácido en la tira de papel tornasol azul, este se convertirá en rojo.

