 La Ley de los gases ideales es una simplificación de gases reales y que se realiza como una forma de estudiarlos más sencillamente. Se le considera como un gas, pero hipotético. Ese gas está compuesto de partículas que son puntuales sin los efectos electromagnéticos.
La Ley de los gases ideales es una simplificación de gases reales y que se realiza como una forma de estudiarlos más sencillamente. Se le considera como un gas, pero hipotético. Ese gas está compuesto de partículas que son puntuales sin los efectos electromagnéticos.
Las colisiones que se producen entre las moléculas y con las moléculas y con las paredes es elástica porque se conserva el momento, además de la energía cinética.
Se puede sintetizar que un gas es ideal cuando todas las colisiones que se producen entre los átomos o las moléculas son totalmente elásticas y en el mismo no existen fuerzas atractivas que sean intermoleculares.
En los gases ideales la energía cinética es proporcional a su temperatura. Los gases se acercan a un gas ideal si son gases mono atómico, si se encuentra a presión y además a temperatura ambiente.
La cantidad de gas de un cuerpo se mide en moles. Un mol de cualquier tipo de gas llega a ocupar 22, 4 litros, en condición normal, 0° centígrados y 1 de la atmósfera de presión. Ese volumen se denomina volumen molar normal.
Los gases ideales tienen una ecuación denominada Ecuación del gas ideal y está fundamentada en tres leyes principales que son la ley de Boyle, la ley de Gay-Lussac, la ley de Charles y también la ley de Avogadro.
Indice
Ley combinada de los gases
También recibe el nombre de ley general de los gases. Esta ley realiza una combinación de la ley de Boyle, la ley de Gay Lussac y la ley de Charles.
Son leyes matemáticas que se refieren a todas las variables que son termodinámicas con relación a las otras cuando todo lo demás se queda constante.
Ecuación del gas ideal
También se denomina Ley de Charles y se trata de las transformaciones que se producen en un gas si la presión es constante. Si la temperatura se encuentra cerca del cero absoluto los gases tendrán igual comportamiento.
Ecuación de estado
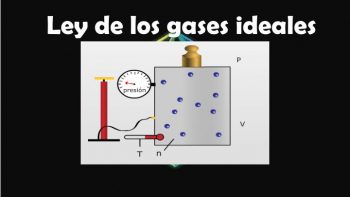
Es una ecuación con la que se describe la relación que existe entre la presión, la temperatura el volumen y la cantidad de moles de un gas.
Ejemplo: P.V = n.R.T
En esta ecuación P es la presión, V es el volumen, n son los moles de gas, R es la constante universal que tienen los gases ideales y T es la temperatura absoluta.
Ley de Boyle
 La ley de Boyle es la que tiene que ver con los procesos y transformaciones que experimentan los gases cuando su temperatura se mantiene constante. La curva que presenta el siguiente gráfico P contra Volumen, pertenece a una isotérmica, lo que quiere indicar todos los puntos en donde la temperatura es igual.
La ley de Boyle es la que tiene que ver con los procesos y transformaciones que experimentan los gases cuando su temperatura se mantiene constante. La curva que presenta el siguiente gráfico P contra Volumen, pertenece a una isotérmica, lo que quiere indicar todos los puntos en donde la temperatura es igual.
Ley de Gay _Lussac
La ley de Gay_Lussac es la que tiende a establecer la relación que hay entre la temperatura y la presión que tiene un gas cuando su volumen también es constante.
Ley de Avogadro
Lleva su nombre en honor a Amedeo Avogrado, químico y físico italiano que nació en 1776 y murió en 1856. Esta ley establece una relación que hay entre la cantidad de gas y de volumen si se mantienen siempre constantes tanto la temperatura como la presión.
Esta ley indica que los volúmenes que son iguales, pero de diferentes sustancias gaseosas y medidos en igual condición de temperatura y de presión tienen en su interior la misma cantidad de partículas.
Y en donde:
- P= es igual a la presión que tiene el gas.
- V= el volumen que tiene el gas.
- n= el número de los moles.
- T= la temperatura que tiene el gas con la medida en Kelvin.
- R= la constante que mantiene los gases ideales.
Ley de los gases Perfectos
Este gas puede reducir su volumen si es sometido a compresión por esfuerzos externos. Cuando se encuentra en un recipiente que es elástico; se divide de manera uniforme dentro del mismo y tiene un coeficiente de una viscosidad muy reducida lo que le permite tener mucha facilidad para fluir por distintas conducciones que sean adecuadas.

