 La configuración electrónica que tiene un átomo en un elemento es correspondiente a la posición de los electrones en cada una de las órbitas de los distintos niveles energéticos.
La configuración electrónica que tiene un átomo en un elemento es correspondiente a la posición de los electrones en cada una de las órbitas de los distintos niveles energéticos.
A pesar de que el modelo Schrödinger sólo es necesario en el átomo de hidrógeno, en otros átomos este modelo puede aplicarse para aproximaciones adecuadas.
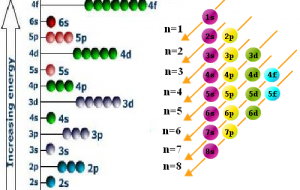
La manera de enseñar la forma en la cual se encuentran distribuidos los electrones de un átomo es con la configuración electrónica. El orden en el cual los niveles de energía son llenados es el siguiente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p.
El esquema o formato de llenado en las órbitas atómicas se puede obtener aplicando la regla diagonal, para esto se sigue de forma cuidadosa la flecha del esquema que empieza en 1s. Haciendo esto se puede completar cada órbita con los electrones adecuadamente.
Indice
Tipos de Configuración Electrónica
La configuración electrónica también puede definirse como una representación escrita de la división y distribución de los electrones que tiene un átomo, de acuerdo con el modelo cuántico.
En la configuración electrónica de un átomo se enseña la cantidad de electrones que existen en los niveles y subniveles, teniendo presente el orden del principio de la construcción progresiva, también llamada regla de diagonales.
Los diferentes tipos de configuración electrónica son:
- Configuración condensada
Los niveles que están completos en la configuración estándar pueden presentarse junto a un gas noble.
- Configuración por defecto
Se consigue empleando una caja diagonal.
- Configuración semidesarrollada
Combinación entre la configuración desarrollada y la configuración condensada.
- Configuración desarrollada
Representa cada uno de los electrones de un átomo a través de flechas que hacen la función de símbolo de rotación de cada uno de los mencionados.
Configuración Electrónica Externa
 La configuración electrónica, también conocida como estructura electrónica, es la distribución o disposición de los electrones en cada nivel energético que rodea al núcleo atómico.
La configuración electrónica, también conocida como estructura electrónica, es la distribución o disposición de los electrones en cada nivel energético que rodea al núcleo atómico.
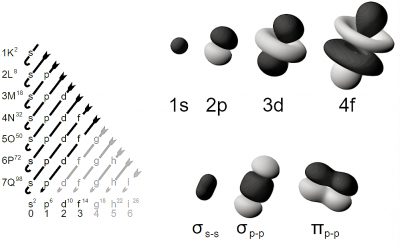
De acuerdo con el modelo atómico antiguo de Bohr, los electrones se localizan en diferentes niveles en órbitas rodeando el núcleo, empezando en la primera capa que se encuentra más cercana a este y se llama K, hasta la séptima capa conocida como la Q, esta se encuentra más lejos del núcleo.
En concepto de modelo mecánico cuántico refinado, ambas capas están subdivididas en un conjunto de orbitales, cada uno de estos puede ocuparse por un máximo de un par de electrones.
Es común que la configuración electrónica se use para la descripción de las órbitas de un átomo cuando tiene un estado fundamental, pero también puede usarse para la representación de un átomo que se ha ionizado en un anión o en un catión, compensando la ganancia o la pérdida de los electrones en sus órbitas respectivas.
La mayoría de las propiedades químicas y físicas de los elementos pueden estar correlacionadas con configuraciones electrónicas en especial. Los electrones de la capa exterior y los electrones de valencia son el factor que determina la química única que tiene el elemento.
Importancia de los Tipos de Configuración Electrónica
Las configuraciones electrónicas tienen un importante papel en la definición de las propiedades de cada uno de los átomos. Cada átomo que pertenece a un mismo grupo posee la misma configuración electrónica externa, a excepción del número atómico n, por esto sus propiedades químicas se parecen.
Algunos de los factores principales que se destacan en las propiedades atómicas son la energía de las órbitas de gran energía, el tamaño de las órbitas de mayor tamaño, la cantidad de electrones en las órbitas de gran energía y el número de órbitas vagas.
Casi todas las propiedades atómicas pueden relacionarse con el grado de atracción entre la parte externa del número de electrones y el núcleo, en la capa externa de los electrones y en la cantidad de electrones que tiene el electrón de valencia.

