Las pro piedades coligativas son aquellas propiedades independientes de la naturaleza del soluto, o sea, solo llegan a depender de la cantidad de moléculas de soluto en reacción con la cantidad total de moléculas que hallan en la disolución, por suma de cierto soluto no volátil.
piedades coligativas son aquellas propiedades independientes de la naturaleza del soluto, o sea, solo llegan a depender de la cantidad de moléculas de soluto en reacción con la cantidad total de moléculas que hallan en la disolución, por suma de cierto soluto no volátil.
Se trata de las propiedades físicas que una solución llega a presentar. Estas no llegan a depender directamente de la naturaleza del soluto más bien de la concentración que haya de este en la solución, o más bien de la cantidad de partículas de soluto que puede haber en la solución.
Indice
Propiedades coligativas de las soluciones
Variación de la presión de vapor
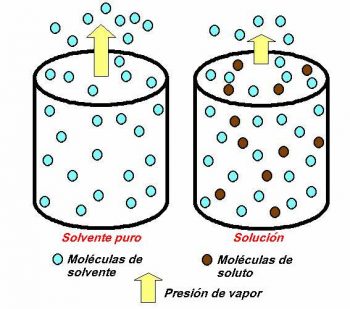 Esta propiedad es el resultado del análisi de la relación entre el solvente y el soluto de una determinada solución. Surge por la disminución de la concentración de un solvente cuando presenta partículas del soluto. La presión del vapor en este caso será esa presión que es ejercida por un vapor cuando está en equilibrio con su líquido.
Esta propiedad es el resultado del análisi de la relación entre el solvente y el soluto de una determinada solución. Surge por la disminución de la concentración de un solvente cuando presenta partículas del soluto. La presión del vapor en este caso será esa presión que es ejercida por un vapor cuando está en equilibrio con su líquido.
Aumento del punto de ebullición
Cuando en una solución se adiciona un soluto no electrolito al solvente, se crea una disminución en la presión del vapor en el solvente. Si es menor esta presión la temperatura deberá de ser aumentada para que cedan las interacciones entre el solvente y el soluto y pasen así las moléculas solventes a un estado de vapor para conseguir así un equilibrio entre la presión del entorno y la presión del solvente.
Disminución del punto de fusión
También se nombra como disminución del punto de congelación. Esto corresponde a la temperatura en donde los primeros cristales de disolvente se comienzan a formar manteniendo un equilibrio con la disolución. Al adicionar un soluto a un solvente la presión del solvente no disminuirá más bien se producirá un congelamiento en la solución a temperatura menor que la que presenta el solvente.
Presión Osmótica
Esta se crea al aumentar la presión que se adiciona a la presión de vapor de una solución. Cuando se aplica cierta presión a la solución se evita la generación de este tipo de presión.

