 La ley de las proporciones múltiples es llamada también ley estequiométrica y la enunció John Dalton, en 1803. En la práctica la demostró el químico francés Gay Lussac.
La ley de las proporciones múltiples es llamada también ley estequiométrica y la enunció John Dalton, en 1803. En la práctica la demostró el químico francés Gay Lussac.
La estequiometría es como se denomina a la vinculación numérica establecida entre las masas de los elementos que constituyen la sustancia. También recibe ese nombre la proporción que se registra en elementos que se combinan mientras se produce una reacción química.
La ley de las proporciones múltiples señala que cuando dos elementos, por ejemplo: A y B, tienen la capacidad de combinarse entre ellos para lograr la formación de compuestos diferentes, entonces, las distintas masas que posee B y que se unen o enlazan a cierta masa que posee A, se encuentran en relación de números que son enteros y sencillos.
El estudio de las distintas cantidades en las cuales varias sustancias participan de una misma reacción química ha sido objeto de grandes químicos de la historia como Lavoisier, Proust entre 1754 y 1826, además el químico, naturista, meteorólogo, matemático británico John Dalton entre los años 1766-1844 y el alemán J.B Richter de 1824 a 1898 quienes enunciaron distintas leyes que agrupadas se denominan leyes ponderales o también que son relativas al peso.
El uso del concepto peso en la química se sustituyó luego por el de la masa, de forma tal que las leyes ponderales se refieren a las diferentes proporciones en la masa que son características de combinaciones en química. Esas leyes se enunciaron antes de que se tuviera la disposición de un modelo atómico acerca de la constitución de la materia y que contribuyeron a formular el modelo de Dalton.
Indice
Ley de las proporciones múltiples
Características de un Compuesto
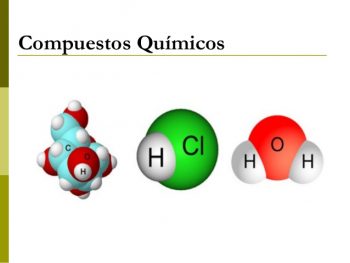 En química, un compuesto es el nombre que recibe la sustancia química que está formada por varias moléculas o cristales de dos o también más átomos o iones de los elementos que son diferentes y que se unen entre sí.
En química, un compuesto es el nombre que recibe la sustancia química que está formada por varias moléculas o cristales de dos o también más átomos o iones de los elementos que son diferentes y que se unen entre sí.- Un compuesto es un elemento que se crea partiendo de la suma de diferentes partes.
- Los compuestos orgánicos tienen una propiedad denominada combustibilidad mediante la cual pueden llegar a quemarse.
- También existen los compuestos iónicos que poseen atracción electrostática la cual los mantiene unidos.
Proporciones de masa
Esta ley señala que la composición de una determinada combinación es la misma siempre y que el porcentaje o la proporción en la cual intervienen los distintos elementos es constante y también característica de una sustancia compuesta. Por ejemplo, en el amoníaco (NH3) se tiene que la proporción en masa de nitrógeno/hidrógeno es la de 4,67:1 cualquiera que sea el tipo de muestra que se tome en cuenta.
Ley de Proust o de las proporciones definidas
Esta ley fue enunciada en 1801 y afirma que “Cuando dos o más elementos reaccionan para dar lugar al mismo compuesto lo hacen siempre en la misma proporción ponderal”.
Ley de Dalton o de proporciones múltiples
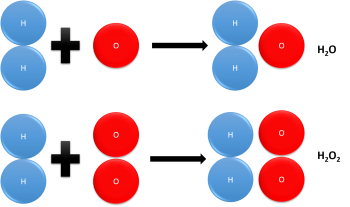 Esta ley fue creada en 1803 y considera que cuando se unen dos elementos para lograr formar más de un compuesto, entonces, las cantidades que tiene un mismo elemento y que se combinan con la cantidad que es fija de otro elemento, ambos guardan una relación entre sí que corresponderá a los números enteros y sencillos.
Esta ley fue creada en 1803 y considera que cuando se unen dos elementos para lograr formar más de un compuesto, entonces, las cantidades que tiene un mismo elemento y que se combinan con la cantidad que es fija de otro elemento, ambos guardan una relación entre sí que corresponderá a los números enteros y sencillos.
Ley de Lavoisier
La ley de Lavoisier fue enunciada en 1789 y sostiene que “La suma de la masa de los reactivos tiene que ser igual a la suma de la masa de los productos”. La masa se conserva, no se crea ni tampoco se destruye, permanece invariable y solo se transforma.
Leyes ponderales
Las leyes ponderales son un grupo de leyes cuyo objetivo es estudiar el peso relativo de distintas sustancias en una determinada reacción química o entre varios elementos químicos. Estas leyes llevan el nombre de ponderales porque se refieren al peso que tienen las sustancias que reaccionan y son leyes empíricas.
Ley de Richter
También recibe el nombre de Ley de las proporciones recíprocas o equivalentes y fue enunciada en el año 1792 y afirma que: “Los pesos de dos sustancias que se combinan con un peso conocido de una tercera sustancia son químicamente equivalentes entre sí.”

