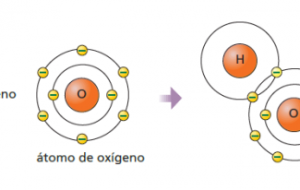
 El elemento oxígeno es un elemento químico, su símbolo se representa con la letra O, su número atómico es el 8. En condiciones normales de temperatura y de presión, dos átomos de este elemento se conectan para crear el dioxígeno.
El elemento oxígeno es un elemento químico, su símbolo se representa con la letra O, su número atómico es el 8. En condiciones normales de temperatura y de presión, dos átomos de este elemento se conectan para crear el dioxígeno.
Este es un gas incoloro, diatómico. insípido e inodoro. Su fórmula es O2. Esta sustancia es una parte importante de la atmósfera y es completamente necesaria para la subsistencia en la vida en la tierra.
El oxígeno integra al grupo de los anfígenos en la tabla periódica. Este elemento es un no metal, es sumamente reactivo. Crea compuestos de manera fácil con casi todos los elementos, mayormente con los óxidos, a excepción de los gases nobles neón y helio. De igual forma, es un agente oxidante fuerte. Es el segundo con la mayor electronegatividad de todos los elementos, únicamente superado por el flúor.
Al medirse por su masa, el oxígeno es el tercer elemento de más abundancia en el universo, después del helio y del hidrógeno. También es el que más abunda en la corteza de la tierra debido a que básicamente es la mitad de la masa terrestre. Gracias a su reactividad química, no puede establecerse en la atmósfera como un elemento libre sin reabastecerse continuamente por la acción fotosintética de los organismos que usan la energía solar para crear oxígeno elemental partiendo del agua.
Indice
Configuración Electrónica del Oxígeno
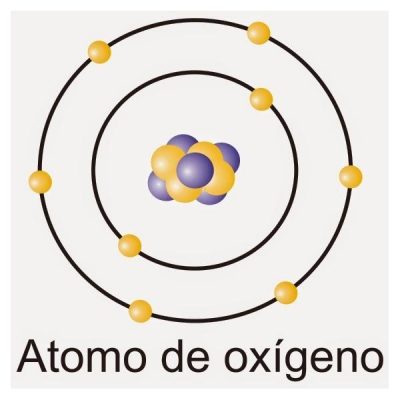
 La configuración electrónica del oxígeno es 1s2 2s2 2p4 mientras que su versión abreviada y simplificada se escribe como [He] 2s2 2p4.
La configuración electrónica del oxígeno es 1s2 2s2 2p4 mientras que su versión abreviada y simplificada se escribe como [He] 2s2 2p4.
Propiedades del Oxígeno
Debido a que el oxígeno forma parte de la mayoría de la masa acuífera, este también es el mayor componente de masa en los seres vivos.
La mayoría de las moléculas de mayor importancia de los seres vivos como los ácidos nucleicos, proteínas, lípidos y carbohidratos están compuestos de oxígeno.
También los compuestos orgánicos principales que conforman los dientes, caparazones y huesos de animales. El oxígeno elemental se crea por algas, cianobacterias y plantas de todas las complejas formas de vida.
Es usado para la respiración celular. El ozono permite la protección de la biosfera a gran altitud, principalmente de la radiación ultravioleta, a este se le llama capa de ozono. Pero contamina próxima a la superficie porque es un subproducto del smog. En altitudes mayores a la órbita terrestre, el oxígeno atómico está presente y produce erosión en naves espaciales.
Las industrias lo producen a través de la destilación fraccionada de aire licuado, la electrólisis del agua, la utilidad de zeolita junto a ciclos de presión para la concentración del oxígeno del aire y otros mecanismos. El oxígeno se usa para producir plásticos, acero, textiles, oxigenoterapia, propulsión de cohetes y asistir a la respiración de aeronaves, vuelos espaciales y submarinos.
Estructura del Oxígeno
 En condiciones normales de temperatura y presión el oxígeno es inodoro, incoloro y su fórmula molecular es O2.
En condiciones normales de temperatura y presión el oxígeno es inodoro, incoloro y su fórmula molecular es O2.
Los dos átomos de oxígeno se conectan junto a una configuración electrónica en un estado triplete. este enlace se ordena en dos y simplifica las descripciones de enlace doble o de combinación de un enlace con dos enlaces de tres electrones y dos electrones.
El Oxígeno y la Respiración
El oxígeno se libera a través de las bacterias fotosintéticas, las plantas y las algas gracias a la fotosíntesis. En el procedimiento inverso, los organismos aerobios a través de la respiración utilizan el oxígeno para transformar los nutrientes en energía.
La disminución de oxígeno produce hipotermia, la ausencia total de este provoca anoxia, lo cual lleva a la muerte.
El contenido de oxígeno que tiene un cuerpo de un ser vivo es básicamente mayor en el sistema respiratorio y va disminuyendo a través de los sistemas arteriales, sistema venoso y tejidos periféricos.

