E l estroncio forma parte de la tabla periódica. Es un elemento químico cuyo número atómico es 38, su símbolo es Sr. Se caracteriza por ser un metal blando, su color es brillante y plateado, tiene cierta maleabilidad, es alcalinotérreo. Tiene rápida oxidación cuando entra en presencia con el aire obteniendo un color amarillento debido a la formación de óxido, por lo tanto debe conservarse al sumergirse en parafina.
l estroncio forma parte de la tabla periódica. Es un elemento químico cuyo número atómico es 38, su símbolo es Sr. Se caracteriza por ser un metal blando, su color es brillante y plateado, tiene cierta maleabilidad, es alcalinotérreo. Tiene rápida oxidación cuando entra en presencia con el aire obteniendo un color amarillento debido a la formación de óxido, por lo tanto debe conservarse al sumergirse en parafina.
Gracias a su alta reactividad, este metal se halla en la naturaleza en combinación con otros elementos creando compuestos. Reacciona de forma rápida con el agua al liberar hidrógeno molecular para crear el hidróxido de estroncio. Tiene tres estados alotrópicos con puntos de transición que van desde los 235 grados centígrados hasta los 540 grados centígrados.
Este metal arde cuando se encuentra presente en el aire, de forma espontánea si es un polvo dividido finamente. Su llama es rosada roja y forman nitruro y óxido porque el hidrógeno no tiene reacción cuando está debajo de los 380 grados centígrados y forma solamente el óxido cuando este arde a temperatura ambiental. Las sales volátiles del estroncio le otorgan un color carmesí a las llamas, por eso son utilizadas en la pirotecnia.
Indice
Configuración Electrónica del Estroncio
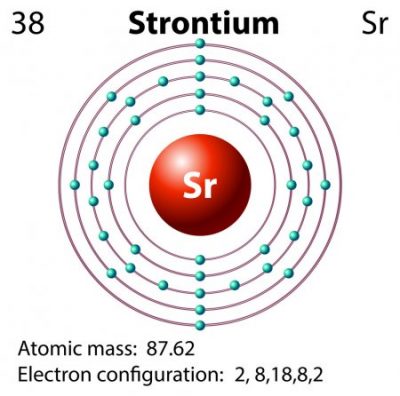
El número atómico del estroncio es 38. Su configuración electrónica completa es 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 3d 10 -4s2 – 4p6 – 5s2. Su configuración electrónica simplificada es [Kr] 5s2
Aplicaciones del Estroncio
Actualmente, la utilidad más destacada de este elemento en la ciencia es construir relojes atómicos de mayor precisión y modernidad superando a los relojes atómicos de cesio utilizados hasta la fecha.
Hasta hace algún tiempo, también se empleaba el estroncio en cristales para tubos de rayos catódicos que tenían los televisores a color porque existían regulaciones legales que obligaban a hacer uso de este metal para la filtración de los rayos X, impidiendo que incidieran en el espectador. Otros usos del estroncio son:
- Para producir imanes de ferrita.
- En la pirotecnia con el nitrato.
- El titanato de estroncio posee un índice de refracción sumamente alto y una dispersión óptica más grande que la del diamante, estas propiedades son interesantes en distintas aplicaciones ópticas. Ocasionalmente se ha empleado como gema.
- El carbonato se utiliza en el refino del zinc para eliminar el plomo mientras se realiza la electrólisis, como componente de distintas aleaciones y el la desulfurización del acero.
- El ranelato de estroncio es un fármaco que se usa para el tratamiento de la osteoporosis, prescrito en la Unión Europea pero no en Estados Unidos.
- El isótopo radiactivo Sr-85 se usa en radiología, el Sr-89 se utiliza en la terapia contra el cáncer y el Sr-90 en generadores autónomos de energía.
- Existen otros compuestos de estroncio que se emplean en fabricar productos de vidrios, cerámicas, lámparas fluorescentes, pigmentos para pinturas y medicamentos.
Advertencias sobre el Estroncio en el Ser Humano
El estroncio puro es sumamente reactivo, arde de forma espontánea cuando entra en contacto con el aire, por lo tanto es considerado un riesgo de incendio. El cuerpo humano obtiene el estroncio de igual forma que el calcio. Las formas no radiactivas y estables del estroncio no producen efectos dañinos en la salud pero el Sr-90 radiactivo es acumulado en el cuerpo alargando la exposición a la radiación y provocando distintos desórdenes dentro de los cuales se incluye el cáncer de hueso.
Existen otras sales de estroncio tales como carbonato o citrato de estroncio que se presenta como terapias naturales y se venden en dosis muy altas que las que normalmente pueden ingresar al cuerpo humano. No se sabe con exactitud los efectos a largo plazo de estas utilidades porque nunca se han evaluado en humanos haciendo experimentos a escala médica larga.

