 El litio se define como un elemento químico, su número atómico es igual a 3 y su representación simbólica es Li. Se ubica en el grupo 1 de la tabla periódica, justamente en los elementos alcalinos. En su forma pura, el litio tiene una tonalidad blanco plata, es un metal blando y posee rápida oxidación con el agua o el aire. Su densidad es igual a la mitad de la del agua, es el elemento y metal sólido de mayor ligereza.
El litio se define como un elemento químico, su número atómico es igual a 3 y su representación simbólica es Li. Se ubica en el grupo 1 de la tabla periódica, justamente en los elementos alcalinos. En su forma pura, el litio tiene una tonalidad blanco plata, es un metal blando y posee rápida oxidación con el agua o el aire. Su densidad es igual a la mitad de la del agua, es el elemento y metal sólido de mayor ligereza.
Similar a los otros metales alcalinos, el litio tiene gran reactividad y es univalente pero en menor proporción al sodio. Por lo tanto no se encuentra de forma libre en la naturaleza. Cuando se acerca a una llama, esta adquiere un tono carmesí. Cuando la combustión es violenta, esta cambia a un tono blanco y de mucho brillo.
Se utiliza básicamente en baterías eléctricas, en aleaciones que conducen el calor y en sus sales para tratar el trastorno bipolar. El nombre griego del litio significa piedra, este nombre se origina porque el elemento fue descubierto en un mineral y los otros metales alcalinos se descubrieron en tejidos vegetales.
Indice
Configuración Electrónica del Litio
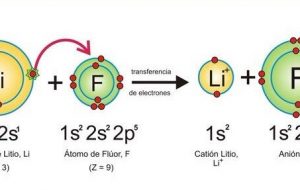
 Cada uno de los elementos puede ser identificado gracias a su número atómico Z, este es el mismo número de electrones y protones que tiene el núcleo. El número atómico del litio es 3, por lo tanto, el átomo de litio posee 3 electrones. 2 de ellos ocupan el orbital 1s, el tercero se ubica en el orbital 2s, lo que significa que se encuentra en un orbital de energía mayor.
Cada uno de los elementos puede ser identificado gracias a su número atómico Z, este es el mismo número de electrones y protones que tiene el núcleo. El número atómico del litio es 3, por lo tanto, el átomo de litio posee 3 electrones. 2 de ellos ocupan el orbital 1s, el tercero se ubica en el orbital 2s, lo que significa que se encuentra en un orbital de energía mayor.
La configuración electrónica del litio es 1s22s1 y de forma simplificada corresponde a [He] 2s1.
Esto sucede porque se tiene presente el elemento contiguo que en el caso del litio es el helio. La configuración de este es 1s2, similar a la órbita con la que inicia la configuración tradicional del litio. De tal manera que únicamente se usa el símbolo atómico del helio y se ubica en el soporte expresando que el litio tiene similar configuración que el helio, uniendo la órbita 2s1.
Es posible identificar este elemento gracias al símbolo Li que se ubica en el grupo 1, luego de los elementos alcalinos que pertenecen a la tabla periódica. El litio es presentado en estado puro como un metal blando, cuando entra en contacto con el aire o el agua tiene una rápida oxidación, es de mucha utilidad en aleaciones que van a favor del calor.
Papel Biológico del Litio
Se tiene entendido que el litio sustituye al sodio en las membranas biológicas, también ayuda a aumentar la permeabilidad celular y trabaja en los neurotransmisores facilitando la estabilidad del estado de ánimo. Por esta razón, el litio se usa para prevenir y tratar episodios de manía en la bipolaridad.
Precauciones del Litio
Como sucede con demás metales alcalinos, el litio puro tiene una ligera explosividad y es muy inflamable al exponerse al agua y al aire. Es corrosivo y necesita de un empleo con medios correctos de manipulación para impedir que contacte con la piel. Debe guardarse en un hidrocarburo líquido como aceite mineral o vaselina. Puede producir hipotiroidismo al evitar el ingreso del yodo a la hormona de la tiroides.
Obtención y Abundancia
El litio tiene una abundancia moderada en la corteza terrestre dividiéndose en 65 partes de un millón. Se ubica debajo del cobre, níquel y wolframio y por encima del estaño y cerio en abundancia ambiental. Los países de Bolivia, Argentina, Perú y Chile poseen el 85% de reservas de litio en todo el mundo. Los minerales principales de los cuales es extraído este elemento son petalita, lepidolita, ambligonita y espodumena. En los Estados Unidos se consigue de las salinas ubicadas en Nevada y en California.

