 En la teoría de colisiones se explican cómo suceden las reacciones químicas y las velocidades en las que estas tienen reacción. Esta teoría fue propuesta en el año de 1916 y 1918 por los químicos Max Trautz y William Lewis.
En la teoría de colisiones se explican cómo suceden las reacciones químicas y las velocidades en las que estas tienen reacción. Esta teoría fue propuesta en el año de 1916 y 1918 por los químicos Max Trautz y William Lewis.
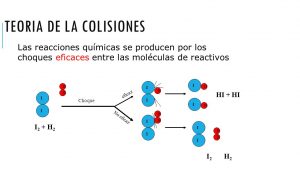
Según dicta esta teoría para que una reacción llegue a ocurrir las partículas reaccionantes tienen que colisionar. Sólo cuando ocurre una colisión que tiene cierta fracción de colisiones pueden causar un cambio químico.
Cuando ocurren este tipo de colisiones que se convierten en un cambio químico usualmente son llamadas como colisiones exitosas. Estas colisiones tienen una suficiente energía, la cual se denomina como “energía de activación”.
Al momento en el que ocurre el impacto tiene la finalidad de romper enlaces y crear nuevos haciendo que esto resulte en una producción de reacción. Esta teoría se encuentra totalmente relacionada con la cinética química.
Indice
La teoría de las colisiones
Sobre Max Trautz
 Max Trautz fue el fundador de la teoría de la colisión. Era conocido por ser un físico alemán, el cual tenía más de 190 publicaciones científicas, las cuales eran especialmente sobre el campo de la química cinética.
Max Trautz fue el fundador de la teoría de la colisión. Era conocido por ser un físico alemán, el cual tenía más de 190 publicaciones científicas, las cuales eran especialmente sobre el campo de la química cinética.
Este tuvo la publicación de su trabajo sobre la teoría de la colisión para el año de 1918. Estudió en la universidad de Karlsruhe y Heidelberg, y su muerte se remonta a la fecha del 19 de agosto de 1960.
Sobre Williams Lewis
- Al igual que Max, Williams Lewis fue uno de los que desarrolló la teoría de las colisiones, sin embargo, este publicó su teoría para el año de 1916, pero ninguno de los dos sabía sobre el otro debido a que esto tomó lugar para la primera guerra mundial.
- Era un profesor de la universidad de Liverpool, y se desconocía mucho sobre su vida. Fue un físico- químico británico que murió para la fecha del 11 de febrero del año 1958 en la edad de 70 años.
- Otra de sus obras más conocidas tenía por nombre: el sistema de la química física, 3 volúmenes.
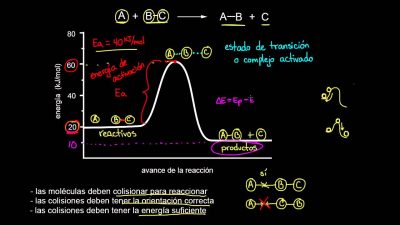
¿Qué es la energía de activación?
 Es un tipo de energía necesaria para un sistema cualquiera que suele ser relevante para cuando este pretende iniciar un determinado proceso.
Es un tipo de energía necesaria para un sistema cualquiera que suele ser relevante para cuando este pretende iniciar un determinado proceso.
Tiende a utilizarse para que se pueda denominar la energía mínima que es utilizada a la hora de producir una reacción química dada, sin embargo para que ocurra una reacción estas tienen que colisionar en dirección correcta.
A medida en que las moléculas se vienen aproximando, las nubes de sus electrones comienzan a repelerse entre ellos. Para que esto logre superarse se requiere de una energía proveniente de la energía térmica del sistema.
Si la energía proporcionada es suficiente se podrá vencer dicha repulsión que se encuentra formada en la nube de electrones, y las moléculas que se encuentran en aproximación producen una re-ordenación entre sus enlaces.
Según el origen, este tipo de energía se clasifica como:
- Químico.
- Eléctrico.
- Nuclear.
- Mecánico.
En lo químico la energía exotérmica tiende a desprenderse del calor, en lo eléctrico esta permite el paso a una corriente, en lo nuclear las fusiones producen el calor y en lo mecánico los cuerpos pueden producir el calor.
Constante de la velocidad
¿Cómo es la constante de la velocidad en la teoría de las colisiones?
Para que una reacción biomolecular se encuentre en fase gaseosa tiene una formula, la cual tiene la capacidad de predecir la teoría de las colisiones:
k (T) = Zp exp (-Ea/RT)
Cada una tiene un propio significado, en el cual:
- z es la frecuencia de dicha colisión.
- p es el factor estérico.
- Ea es esa energía que activa las reacciones.
- T es la temperatura.
- R es la constante.

